introduction
En février 2017, le brodalumab (Siliq ™; Valeant Pharmaceuticals, New Jersey, États-Unis) a reçu l'approbation de la US Food and Drug Administration (FDA) pour traiter le psoriasis chez les patients adultes qui n'ont pas répondu à d'autres traitements.
Valeant prévoit de démarrer les ventes et la commercialisation du brodalumab aux États-Unis au deuxième semestre 2017.
En raison du risque observé d'idées et de comportements suicidaires, l'étiquetage du brodalumab comprend une boîte d'avertissement et le médicament n'est disponible que dans le cadre d'un programme restreint dans le cadre du programme d'évaluation des stratégies d'atténuation des risques (REMS) de la FDA. Les exigences notables du programme sont incluses ci-dessous.
- Les prescripteurs doivent être certifiés auprès du programme REMS et conseiller les patients sur le risque d'idées et de comportements suicidaires.
- Les patients présentant des symptômes nouveaux ou aggravés de dépression ou de tendances suicidaires doivent être référés à un professionnel de la santé mentale, le cas échéant.
- Les patients doivent signer un formulaire d'accord patient-prescripteur et être conscient de la nécessité de consulter un médecin s'ils éprouvent des pensées ou des comportements suicidaires nouveaux ou s'aggravant, des sentiments de dépression, d'anxiété ou d'autres sautes d'humeur.
- Les pharmacies doivent également être certifiées par le programme REMS et ne doivent délivrer du brodalumab qu'aux patients autorisés à recevoir le médicament.
Aucune association causale entre le traitement par le brodalumab et le risque accru d'idées et de comportements suicidaires n'a pas été établie.
Psoriasis en plaques chronique
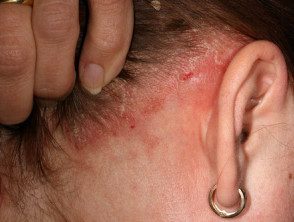
Psoriasis du cuir chevelu
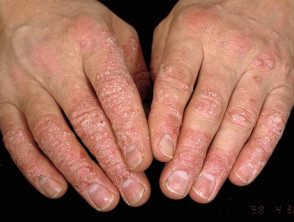
Psoriasis des mains.
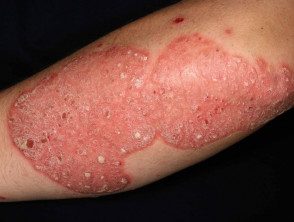
Psoriasis en plaques chronique
À quoi sert le brodalumab?
Le brodalumab est utilisé pour le traitement des patients adultes présentant une plaque d'immatriculation psoriasis qui sont candidats à systémique thérapie ou photothérapie et n'ont pas répondu, ou ont cessé de répondre à d'autres thérapies systémiques.
Il est recommandé aux candidats pour lesquels la thérapie systémique ou la photothérapie n'ont pas réussi à fournir un traitement ou des résultats adéquats.
Comment fonctionne le brodalumab?
Le brodalumab est un monoclonal immunoglobuline G2 (IgG2) anticorps qui inhibe inflammatoire réactions et se lie sélectivement à la destinataire de interleukine 17 (IL-17), a cytokine ce qui commence inflammation.
Le récepteur de l'IL-17 est une protéine exprimée à la surface des cellules et est un composant des complexes récepteurs utilisés par plusieurs familles d'IL-17. cytokines, tels que IL-17A, IL-17F, IL-17C, hétérodimère IL-17A / F et IL-25. Le blocage du récepteur IL-17 inhibe les réponses induites par les cytokines IL-17, y compris la libération de pro-inflammatoire cytokines et chimiokines associé à la Pathogénèse psoriasis
Comment le brodalumab est-il administré?
Le brodalumab est administré par voie sous-cutanée. Chaque seringue préremplie (1,5 ml) contient 210 mg de brodalumab et est à usage unique.
- La dose recommandée de brodalumab est de 210 mg administrée par sous-cutanée injection aux semaines 0, 1 et 2, suivie de 210 mg toutes les 2 semaines.
- Si une réponse adéquate n'est pas obtenue après 12 à 16 semaines de traitement, le traitement par brodalumab doit être interrompu.
- Le brodalumab ne doit pas être injecté dans les zones où la peau est sensible, contusionnée, rouge, dure, épaisse, squameuxou atteint de psoriasis.
- Le brodalumab est contre-indiqué chez les patients atteints de la maladie de Crohn, car le médicament peut aggraver la maladie.
- Les patients ayant des antécédents de latent la tuberculose doit être traitée avant l'administration de brodalumab, qui peut réactiver la tuberculose latente infection.
L'utilisation du brodalumab dans des populations spécifiques
Femmes enceintes
Il n'y a pas de données disponibles sur l'utilisation du brodalumab chez les femmes enceintes pour informer les médecins du risque associé aux médicaments de malformations congénitales et de fausses couches.
Aucun effet indésirable sur le développement n'a été observé chez les singes gravides après l'administration sous-cutanée de brodalumab jusqu'à 26 fois la dose humaine maximale recommandée. (Voir Sécurité des médicaments pris pendant la grossesse pour plus d'informations.)
Femmes allaitantes
Il n'y a aucune information sur la présence de brodalumab dans le lait maternel ou ses effets sur le nourrisson. Le rapport bénéfice / risque potentiel doit être pris en compte lors de la prescription de brodalumab à une mère qui allaite. (Voir la lactation et la peau).
Les enfants
L'innocuité et l'efficacité du brodalumab n'ont pas été évaluées chez pédiatrique les patients
Personnes majeures
Les études cliniques avec le brodalumab n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer si les personnes âgées répondraient différemment aux personnes plus jeunes.
Individus avec hépatique ou rénal invalidité
Il n'y a eu aucun essai pour évaluer l'utilisation du brodalumab chez les patients atteints d'insuffisance hépatique ou rénale.
Quels sont les risques avec le brodalumab?
Evènements indésirables
Le plus courant Effets indésirables (≥ 1% de patients) rapportés avec le brodalumab comprennent:
- Arthralgie (douleur articulaire)
- Mal de tête
- Fatigue
- La diarrhée
- Oropharyngée douleur (mal de gorge)
- La nausée
- Myalgie (douleur musculaire)
- Réactions au site d'injection
- Grippe
- Neutropénie (faible nombre de globules blancs)
- Infections fongiques (comme la teigne)
Les effets indésirables graves suivants ont été rapportés lors d'essais cliniques chez des patients traités par brodalumab:
- Idées et comportements suicidaires
- Infections graves comme le cryptocoque méningite
-
Réactivation latente de la tuberculose
- Exacerbation de la maladie de Crohn.
Interactions médicamenteuses
Il n'y a pas de données disponibles sur la capacité des vaccins vivants ou inactifs à déclencher une réponse immunitaire chez les patients recevant un traitement par brodalumab. Les vaccins vivants ne doivent pas être utilisés pendant le traitement par le brodalumab.
L'effet des médicaments métabolisés par le cytochrome P450 hépatique enzymes (comme la warfarine et la cyclosporine) peuvent être modifiés pendant concurrent l'administration de brodalumab. Il faudrait envisager de modifier les doses de ces médicaments.
Contre-indications
Le brodalumab est contre-indiqué chez les personnes qui:
- Vous avez des antécédents de problèmes mentaux, notamment des pensées suicidaires, de la dépression, de l'anxiété ou des problèmes d'humeur.
- Vous avez des infections récurrentes.
- Vous êtes atteint de tuberculose ou avez été en contact étroit avec une personne atteinte de tuberculose.
- Avez récemment reçu ou prévoyez de recevoir un vaccin
- Prévoyez de tomber enceinte
- Vous allaitez actuellement ou prévoyez d'allaiter.
Quel est le pronostic du traitement par le brodalumab?
Le brodalumab a montré un profil de sécurité acceptable et bon efficacité dans le traitement du psoriasis en plaques modéré à sévère. Fournit une nouvelle thérapie importante dans le traitement du psoriasis où il existe toujours un besoin non satisfait important de nouveaux agents avec de nouveaux mécanismes d'action, un début d'effet rapide et une clairance cutanée totale et améliorée, tout en aidant à atteindre une plus grande adhérence du patient et minimise les problèmes spécifiques de sécurité des médicaments.
Cependant, les preuves actuelles du brodalumab sont insuffisantes pour confirmer le maintien de ces résultats à long terme.
