Qué son cromosomas?
Los cromosomas llevan el genético material de un organismo (reácido eoxirribonucleico, ADN) Hay 23 pares de cromosomas en las células humanas. Estos cromosomas transportan toda la información genética para que cada célula funcione correctamente.
Las anormalidades en los cromosomas pueden causar una variedad de trastornos genéticos que pueden conducir a un retraso en el desarrollo, congénito defectos y función corporal anormal [2].
Estas enfermedades genéticas pueden deberse a la pérdida o ganancia de cromosomas o hay deleciones o duplicaciones de un cromosoma. En estos casos, falta la celda específica genes por lo que no puede producir ciertas proteínas y llevar a cabo su función correctamente. Ejemplos relevantes para dermatología incluir:
-
Abajo síndrome (trisomía 21)
-
Síndrome de Turner (cromosoma X funcional único)
-
Síndrome de DiGeorge.
Que es citogenético ¿pruebas?
Citogenética es el estudio de los cromosomas y su estructura. [1].
Las pruebas citogenéticas implican el análisis de células en una muestra de sangre, tejido, amniótico fluido, médula ósea o cerebrovascular fluido para identificar cualquier cambio en los cromosomas de un individuo.
Existen 3 métodos principales de pruebas citogenéticas.
- Cariotipo rutinario
- Fluorescente en el lugar hibridación (PEZ)
- Hibridación genómica comparativa (CGH) y microarrays hibridación genómica comparativa (aCGH)
Cariotipo
El cariotipo fue uno de los primeros métodos de análisis cromosómico. Este método usa luz microscopía y procedimientos de tinción estandarizados en células en la porción de metafase del ciclo celular cuando los cromosomas están más condensados [3].
Para hacer el cromosómico análisis más efectivo y eficiente, se han desarrollado manchas para unirse al ADN y producir patrones de bandas característicos para identificar diferentes cromosomas [3]. La mancha más utilizada es el tinte de Giemsa. [3]. A través de este proceso, los cromosomas se pueden organizar en un cariograma de 23 pares y cualquier anomalía que implique aneuploidía y grandes translocaciones puede ser identificado.
El cariotipo solo puede identificar cambios en aproximadamente 3 megabases [3]. Cualquier anormalidad que involucre menos de esto no será detectada por el cariotipo rutinario. Se puede usar para identificar el síndrome de Down y el síndrome de Turner.
Cariotipo para el síndrome de Down
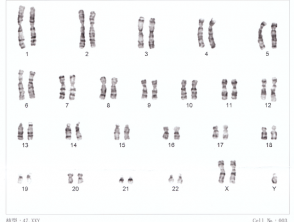
Cromosomas humanos XXY
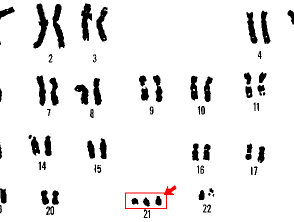
21 síndrome de trisomía Down
Hibridación fluorescente in situ
La hibridación fluorescente in situ (FISH) se introdujo por primera vez a fines de la década de 1980 y se ha convertido rápidamente en una prueba citogenética diagnóstica bien conocida tanto en enfermedades congénitas como adquiridas. [5]. FISH tiene una resolución mucho más alta que el cariotipo rutinario [3], especialmente cuando se usa en células interfásicas [6].
FISH utiliza sondas fluorescentes con secuencias de bases complementarias para localizar la presencia o ausencia de porciones específicas de ADN en los cromosomas. [1,4]. La sonda y el ADN objetivo deben desnaturalizarse con calor o productos químicos para romper los enlaces de hidrógeno en el ADN y permitir que se produzca la hibridación una vez que se mezclan las 2 muestras. [6]. Las sondas fluorescentes forman nuevos enlaces de hidrógeno con sus pares de bases complementarias en el ADN, y esto se puede detectar mediante microscopía. [6].
FISH se usa comúnmente para detectar deleciones o translocaciones cromosómicas específicas asociadas con pediátrico condiciones o cánceres [1]. Los ejemplos incluyen la eliminación del cromosoma 22 en el síndrome de DiGeorge y la translocación de parte de un gene en el cromosoma 22 y 9 en crónico mieloide leucemia [1].
FISH también se usa para melanocítico lesiones para distinguir atípico melanocítico naevi (por ejemplo, Spitz nevo) desde maligno melanoma. Agregue una breve descripción de este uso y otros relevantes para la dermatología.
Hibridación fluorescente in situ en melanoma infantil
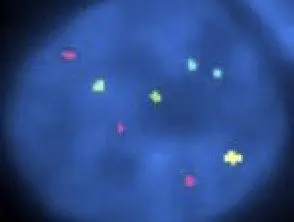
Melanoma infantil FISH patología
Hibridación genómica comparativa
La hibridación genómica comparativa (CGH) es un método de molecular prueba citogenética que detecta variantes de número de copias cromosómicas sin la necesidad de cultivo celular [7]. Primero fue desarrollado para identificar tales cambios en tumores [7,8].
CGH usa 2 genomas; la muestra de prueba y un controlar, los cuales están marcados con fluorescencia para diferenciar entre los dos [8]. Las dos muestras se desnaturalizan y se mezclan juntas, lo que permite la hibridación de los cromosomas metafásicos. La intensidad de la señal fluorescente del ADN de prueba marcado en relación con el ADN de control se puede representar a lo largo de cada cromosoma, lo que muestra la pérdida o ganancia de material genético y permite la identificación de cualquier número de copia. [8].
CGH difiere de otros métodos de prueba citogenética en que no se basa en un objetivo específico, ni requiere conocimiento previo de la región bajo examen [8]. En cambio, CGH puede escanear rápidamente un todo genoma para estos desequilibrios cromosómicos [8] y es útil en casos donde no se conoce el diagnóstico. Una limitación de CGH es el tamaño de la alteración genética que puede identificar, la resolución de CGH es pobre en aproximadamente 5–10 megabases [8].
Hibridación genómica comparativa
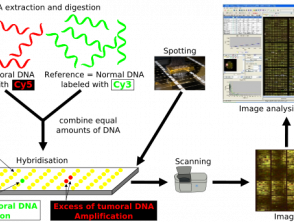
Protocolo de hibridación genómica comparativa de matriz
¿Cuándo se usa este método en dermatología?
Microarray CGH utiliza una técnica similar a CGH pero proporciona una resolución mucho más alta al usar microarrays [8]. Pequeñas secciones de ADN se utilizan como objetivos para el análisis; estas secciones están inmovilizadas en sólido apoyo [8]. Como en CGH, la muestra de ADN y el control están marcados con fluorescencia para diferenciarlos. Las muestras se mezclan y se agregan al microarray donde compiten para unirse a las sondas en el microarray [8]. Se puede evaluar la intensidad de las diferentes señales fluorescentes y se identifican las pequeñas ganancias o pérdidas dentro del ADN. Una desventaja del microarray CHG es que no puede detectar cambios estructurales cromosómicos equilibrados, como translocaciones equilibradas o inversiones. [1].
¿Cuándo se indican las pruebas citogenéticas?
Las pruebas citogenéticas se usan cuando se sospecha una anomalía genética.
Prenatal pruebas en un embarazo de alto riesgo
Las pruebas citogenéticas se realizan en muestras obtenidas en el útero vía amniocentesis o por muestreo de vellosidades coriónicas para identificar a un feto con anomalías cromosómicas, como la trisomía 21 en el síndrome de Down.
Pruebas de diagnóstico
Las pruebas citogenéticas a menudo se usan en pediatría en un intento de identificar la causa subyacente de los trastornos del desarrollo o defectos congénitos. Un diagnóstico puede ser un gran alivio para las familias de los niños afectados y permitirá el asesoramiento sobre el manejo adecuado y pronóstico.
Hematológico cáncer
Las pruebas citogenéticas se usan en cánceres hematológicos como la leucemia mieloide crónica (LMC) donde una translocación recíproca específica entre los cromosomas 22 y 9 da como resultado el cromosoma Filadelfia, que está presente en el 95% de los casos.
Cuales son los contraindicaciones con pruebas citogenéticas?
No hay contraindicaciones médicas para las pruebas citogenéticas.
Se debe obtener el consentimiento informado antes de organizar las pruebas.
¿Cuáles son los beneficios de las pruebas citogenéticas?
Las pruebas citogenéticas pueden ofrecer diagnóstico y ayuda con el manejo a largo plazo de enfermedades relevantes. También permite el asesoramiento genético para los padres sobre el riesgo en futuros embarazos y, en algunos casos, guía al genetista sobre si evaluar a otros miembros de la familia.
¿Cuáles son las desventajas de las pruebas citogenéticas?
Desafortunadamente, las pruebas citogenéticas están limitadas por su resolución. Los diferentes métodos pueden identificar pequeñas ganancias y pérdidas de material genético, así como translocaciones más grandes, pero no permiten la prueba de un solo nucleótido variaciones que podrían contribuir a la condición del paciente. También existe la posibilidad de que las pruebas citogenéticas identifiquen otros cambios cromosómicos que no están necesariamente relacionados con la condición del paciente.
