O que é o cobimetinibe?
O cobimetinibe (Cotellic ™, Genentech Inc. Califórnia, EUA) é um medicamento prescrito usado em combinação com vemurafenibe para tratar pacientes com melanoma.
O cobimetinibe recebeu aprovação da Food and Drug Administration dos EUA. EUA (FDA) nos EUA EUA Em 2015. Em abril de 2017, a Medsafe aprovou o cobimetinibe para o tratamento de pacientes com melanoma na Nova Zelândia.
Melanoma metastático
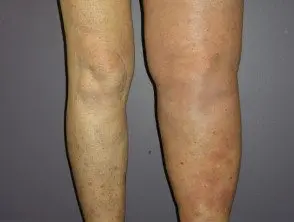
Melanoma metastático
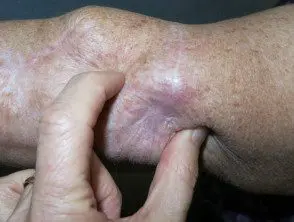
Melanoma metastático
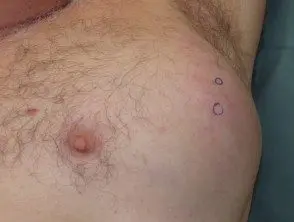
Melanoma metastático
Quem deve tomar o cobimetinibe?
O cobimetinibe, em combinação com vemurafenibe, é indicado para o tratamento de pacientes com doença irressecável ou metastático melanoma, no qual o Câncer se espalhou para outras partes do corpo ou não pode ser removido por cirurgia. Um indicador desse melanoma é um distúrbio anormal. gene Ele chamou o BRAF V600E ou V600K mutação, que deve ser confirmado em tumor amostras antes do início do tratamento.
O cobimetinibe não está indicado no tratamento de pacientes com um tipo normal ou selvagem BRAF gene.
Como o cobimetinibe funciona?
O cobimetinibe é um pequeno molécula inibidor que bloqueia MEK enzima, um componente da cascata de cinase na via da proteína cinase ativada por mitogênio (MAPK). Os componentes das vias MAPK frequentemente sofrem mutações em pacientes com maligno melanoma, particularmente o RAF isoforma BRAF. Mutações do BRAF causar ativação constitutiva dessas vias de sinalização, o que pode levar ao câncer.
O cobimetinibe e o vemurafenibe têm como alvo duas cinases diferentes na via MAPK. Os ensaios clínicos mostraram que a combinação de cobimetinibe com vemurafenibe resulta em melhorias na sobrevida em pacientes com melanoma que abrigam BRAF Mutação V600.
Como o cobimetinibe é administrado?
Dose recomendada
O cobimetinibe está disponível em comprimidos de 20 mg sob a marca Cotellic.
- A dose recomendada é de 60 mg uma vez ao dia nos primeiros 21 dias de cada ciclo de 28 dias, continuada até a progressão da doença ou intolerável toxicidade ocorre.
- O cobimetinibe pode ser tomado com ou sem alimentos.
- Se faltar uma dose ou ocorrer vômito quando a dose é tomada, retome a administração com a próxima dose programada.
O vemurafenibe (ZELBORAF ™) deve ser tomado a cada 12 horas por dia no ciclo de 28 dias (sem período de descanso). Se você perder uma dose de vemurafenibe, ela deve ser tomada assim que você se lembrar. Não compense a dose esquecida se a dose esquecida estiver dentro de 4 horas após a próxima dose programada.
Uso de cobimetinibe em populações específicas.
Mulher grávida
Não há dados disponíveis sobre o uso de cobimetinibe em mulheres grávidas para relatar um risco associado a medicamentos para defeitos congênitos graves e abortos. Com base nos resultados de estudos de reprodução animal e em seu mecanismo de ação, o cobimetinibe pode causar danos fetais. As mulheres grávidas devem ser informadas do risco potencial para o feto.
Mulheres lactantes
Não há informações sobre a presença de cobimetinibe no leite humano ou seus efeitos em uma criança amamentada. O risco-benefício potencial deve ser considerado ao prescrever o cobimetinibe à mãe. As mulheres que amamentam devem ser aconselhadas a não amamentar durante o tratamento com cobimetinibe e por 2 semanas após a dose final.
Crianças
A segurança e eficácia do cobimetinibe não foram avaliadas em crianças.
Mulheres e homens com potencial reprodutivo
Pacientes com potencial reprodutivo devem ser recomendados para usar métodos contraceptivos eficazes durante o tratamento com cobimetinibe e por 2 semanas após a dose final. Com base nas descobertas em animais, o cobimetinibe pode reduzir a fertilidade em fêmeas e machos com potencial reprodutivo.
Pessoas maiores
Os estudos clínicos com cobimetinibe não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem diferentemente a indivíduos mais jovens.
Indivíduos com hepático ou renal incapacidade
Não é necessário ajuste da dose de cobimetinibe em pacientes com comprometimento hepático leve (pontuação de Child-Pugh A), moderado (Child-Pugh B) ou grave (Child-Pugh C). Não dedicado farmacocinética Um estudo foi realizado em pacientes com insuficiência renal. O ajuste da dose não é recomendado para insuficiência renal leve a moderada (depuração da creatinina 30-89 ml / minuto) com base nos resultados da análise farmacocinética da população. Uma dose recomendada não foi estabelecida para pacientes com insuficiência renal grave.
Quais são os possíveis efeitos colaterais do cobimetinibe?
Efeitos colaterais comuns incluem:
- Diarréia
- Erupção
- Fotossensibilidade
- Náusea
- Estomatite
- Febre
- Alopecia
- Trombocitopenia.
Efeitos colaterais incomuns, mas potencialmente graves, incluem:
- Diarréia grave levando à desidratação e insuficiência renal.
- Rabdomiólise
- Toxicidade cardíaca
- Descolamento de retina
- Toxicidade embrião-fetal
- Dor nas articulações (artralgia)
Hepatotoxicidade
Elevações em sérum Os níveis de aminotransferase e fosfatase alcalina são comuns durante a terapia com vemurafenibe e são ainda mais comuns quando combinados com cobimetinibe.
Casos de lesão hepática clinicamente aparente com icterícia Eles foram relatados durante os ensaios clínicos de terapia com cobimetinibe e vemurafenibe, mas as características clínicas, curso e resultados desses episódios não foram descritos em detalhes.
Os inibidores da via MAPK como classe estão frequentemente associados a elevações transitórias da enzima sérica e, mais raramente, a casos de lesão hepática clinicamente aparente, mas as características clínicas não foram descritas e a associação com cobimetinibe não foi claramente definida. .
A taxa de dano hepático clinicamente significativo e insuficiência hepática associada a inibidores de proteína quinase aumenta em pacientes pré-existentes. cirrose ou insuficiência hepática devido à carga do tumor hepático. O rótulo do produto para o cobimetinibe recomenda o monitoramento de testes de rotina da função hepática durante o tratamento.
Elevações séricas de aminotransferase acima de cinco vezes o limite superior do normal (se confirmado) devem levar à descontinuação temporária, que deve se tornar permanente se esses valores laboratoriais não melhorarem significativamente ou resolverem dentro de algumas semanas.
Não parece haver reatividade cruzada com outras pessoas tirosina quinase receptor Inibidores Em algumas situações, pode ser apropriado mudar para outro inibidor da proteína cinase.
Risco de novos cânceres.
O cobimetinibe em combinação com vemurafenibe pode causar novos cânceres de pele. Estes podem incluir:
- Cutâneo escamoso célula carcinoma
-
Ceratoacantoma
- Basal carcinoma celular
Problemas de coração
Cardiomiopatia, definido como sintomático e assintomático A fração de ejeção do ventrículo esquerdo (FEVE) diminuída pode ocorrer com o cobimetinibe.
A segurança do cobimetinibe não foi estabelecida em pacientes com base FEVE abaixo do limite inferior institucional normal ou abaixo de 50%.
A FEVE deve ser avaliada antes de iniciar o cobimetinibe, 1 mês após o início e a cada 3 meses após a descontinuação do medicamento. Eventos ventriculares esquerdos disfunção Deve ser gerenciado através de interrupção, redução ou interrupção do tratamento.
Interações medicamentosas
O cobimetinibe é metabolizado no fígado através do sistema do citocromo P450, predominantemente o CYP3A, e é suscetível a interações medicamentosas com inibidores ou indutores potentes dessa enzima microssomal.
A administração concomitante de cobimetinibe com itraconazol (um potente inibidor da CYP3A4) aumentou o cobimetinibe. sistêmico exposição 6,7 vezes.
Concorrente O uso de cobimetinibe e inibidores fortes ou moderados do CYP3A deve ser evitado. Se o uso simultâneo a curto prazo (14 dias ou menos) de inibidores moderados do CYP3A, incluindo certos antibióticos (por exemplo, Eritromicina, Ciprofloxacina) for inevitável (14 dias ou menos), a dose de cobimetinibe deve ser reduzida de 60 para 20 mg
Uma alternativa a um inibidor forte ou moderado do CYP3A deve ser usada em pacientes que tomam uma dose reduzida de cobimetinibe (40 ou 20 mg por dia). Após a descontinuação de um inibidor moderado do CYP3A, o cobimetinibe deve ser reiniciado com a dose anterior.
A administração concomitante de cobimetinibe com um potente indutor do CYP3A pode diminuir a exposição sistêmica do cobimetinibe em mais de 80% e reduzir sua eficácia. O uso simultâneo de cobimetinibe e indutores fortes ou moderados do CYP3A, incluindo, entre outros, carbamazepina, efavirenz, fenitoína, rifampicina e erva de São João, deve ser evitado.
Contra-indicações
O cobimetinibe deve ser retido nas seguintes circunstâncias:
- Uma história de problemas de saúde mental, incluindo pensamentos suicidas, depressão, ansiedade ou problemas de humor.
- Concorrente infecção que não desaparece ou que volta sempre
-
Tuberculose (TB) ou contato próximo com alguém com TB
- Recentemente recebido ou programado para receber uma vacina
- Planeje engravidar
-
Amamentar ou planejar amamentar.

