O que é guselcumabe?
Guselcumabe é um tratamento biológico indicado para psoríase moderada a grave.
A Food and Drug Administration (FDA) dos EUA aprovou o guselcumab (Tremfya™, Janssen Biotech, PA, EUA) para o tratamento de adultos que vivem com doenças moderadas a graves. placa de carro psoríase candidatos a sistêmico terapia ou fototerapia. Guselcumabe é a primeira e única terapia biológica aprovada que bloqueia seletivamente apenas interleucina 23 (IL-23), um citocina Desempenha um papel fundamental na psoríase em placas.
Os pedidos de aprovação do guselcumabe na União Europeia, no Japão e em outros países estão atualmente em análise.
Psoríase em placas grave
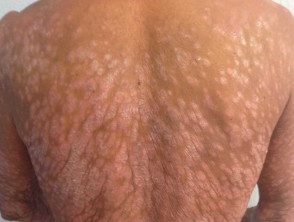
Psoríase grave afetando as costas.
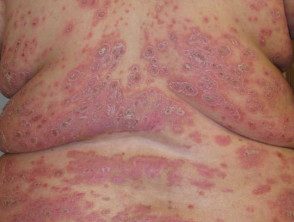
Psoríase grave
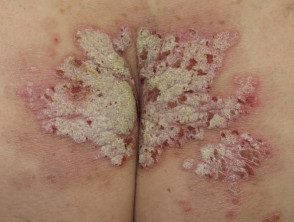
Nádegas com psoríase grave
Para que é usado o guselcumabe?
- Guselcumabe é utilizado no tratamento de pacientes adultos com psoríase em placas moderada a grave, candidatos à terapia sistêmica ou fototerapia (Radiação ultravioleta tratamento).
- Não se sabe se o guselcumab é seguro e eficaz em crianças com menos de 18 anos de idade.
Como funciona o guselcumabe?
- Guselcumabe é um humano monoclonal imunoglobulina G1 lambda (IgG1λ) anticorpo que se liga seletivamente à subunidade p19 da IL-23 (uma proteína envolvida na inflamatório resposta) e inibe sua interação com IL-23 receptor.
- Embora a IL-23 promova respostas inflamatórias e imunológicas normais, as subunidades p19 e p40 da IL-23 são superexpressas na condição de psoríase e outras autoimune doenças inflamatórias da pele.
- Guselcumab liga-se seletivamente à subunidade p19 da IL-23 em células dendríticas e queratinócitos e bloqueia sua interação com o receptor de IL-23, impedindo ainda mais a liberação de outros pró-inflamatórios citocinas e quimiocinas através da estimulação de células imunes, como células T auxiliares 17 (Th17).
- Guselkumab bloqueia assim a sinalização anormalmente elevada de cascatas inflamatórias (o processo de reação em cadeia de ativação da resposta imunitária) que promove epidérmico anormalidades, incluindo queratinócitos hiperproliferação (cicatrização não suprimida de feridas) e formação de placas psoriásicas.
Como o Guselcumabe é administrado?
- Guselcumabe é administrado por subcutâneo injeção.
- A dose recomendada é de 100 mg na semana 0, semana 4 e a cada 8 semanas daí em diante.
- Guselcumabe não deve ser injetado em áreas onde a pele esteja sensível, machucada, vermelha, dura, espessa, escamosoou afetados pela psoríase.
- Destina-se ao uso sob a orientação e supervisão de um médico.
- Guselcumabe pode ser administrado por um profissional de saúde ou um paciente pode se autoinjetar após treinamento adequado na técnica de injeção subcutânea.
- Guselcumabe pode aumentar o risco de infecção.
- Uma dose esquecida deve ser injetada assim que você se lembrar e a próxima dose tomada no horário devidamente programado.
Avaliação pré-tratamento para tuberculose e imunização.
- O tratamento com guselcumabe não deve ser iniciado em pacientes com qualquer infecção ativa clinicamente significativa até que a infecção seja resolvida ou tratada adequadamente.
- Pacientes com histórico de latente A tuberculose deve ser tratada adequadamente antes da administração de guselcumabe, pois pode reativar a infecção tuberculosa latente.
- Os pacientes não devem ser imunizados com vacinas vivas durante o tratamento com guselcumab.
Uso em populações específicas.
Mulheres grávidas
- Não há dados disponíveis sobre o uso de guselcumabe em mulheres grávidas, indicando que existe um risco associado ao medicamento relacionado a defeitos congênitos graves e aborto espontâneo.
- Nenhum efeito adverso no desenvolvimento foi observado em filhotes de 0 a 6 meses de idade em macacos cynomolgus tratados com guselcumabe até 30 vezes a dose humana máxima recomendada.
- Consulte a página da DermNet NZ sobre a segurança dos medicamentos tomados durante a gravidez.
Amamentação e amamentação infantil
- Não há informações sobre a presença de guselcumabe no leite humano ou seus efeitos no lactente.
- O potencial risco-benefício deve ser considerado ao prescrever guselcumab à mãe.
- Consulte a página sobre amamentação e pele da DermNet NZ.
Crianças
A segurança e eficácia do guselcumabe em pediátrico pacientes <18 años de edad no han sido evaluados.
Pessoas maiores
Os estudos clínicos com guselcumab não incluíram um número suficiente de doentes com idade igual ou superior a 65 anos para determinar se respondem de forma diferente dos indivíduos mais jovens.
Pacientes com hepático ou renal incapacidade
Não foram realizados ensaios para avaliar o efeito da insuficiência hepática ou renal na farmacocinética de guselcumabe.
Efeitos adversos do guselcumabe
O mais comum Reações adversas (pacientes ≥ 1%) relatados incluem:
- Infecções respiratórias superiores
- Dor de cabeça
- Reações no local da injeção
- Artralgia
- Diarréia
- Gripe estomacal
-
infecção por micose
-
Infecção por herpes simples.
Interações medicamentosas com guselcumabe
- Não existem dados disponíveis sobre a capacidade das vacinas vivas ou inativadas em provocar uma resposta imunitária em doentes tratados com guselcumab.
- Vacinas vivas não devem ser usadas concomitantemente durante o tratamento com guselcumabe.
- População farmacocinética As análises indicaram que o concomitante O uso de ibuprofeno, aspirina ou paracetamol não afeta a depuração do guselcumab.
- Efeito de drogas metabolizadas pelo citocromo hepático P450 enzimas (por exemplo, varfarina e ciclosporina) podem ser alteradas durante a administração concomitante com guselcumabe. Deve ser considerada a modificação da dosagem destes medicamentos.
- Os resultados de um estudo exploratório de interação medicamentosa em pacientes com psoríase moderada a grave sugeriram um baixo potencial para interações medicamentosas clinicamente relevantes para medicamentos metabolizados pelo CYP3A4 (midazolam), CYP2C9 (varfarina), CYP2C19 (omeprazol) e CYP1A2 (cafeína) . ), mas o potencial de interação de medicamentos metabolizados pelo CYP2D6 (metoprolol) não pode ser descartado.
Contra-indicações para guselcumabe
Guselkumab não deve ser utilizado em pacientes que:
- Você tem uma infecção que não desaparece ou que volta.
- Você tem ou esteve em contato próximo com alguém com TB
- Recentemente recebido ou programado para receber uma vacina
- Planeje engravidar
- Amamentar ou planejar amamentar.
Guselkumab mostra-se promissor para a psoríase em placas em estudos de fase III.
- Guselcumab demonstrou um perfil de segurança aceitável e bom eficácia no tratamento da psoríase em placas moderada a grave.
- É a primeira terapia biológica da sua classe que bloqueia seletivamente apenas a IL-23, uma citocina que desempenha um papel fundamental na psoríase em placas.
- Guselcumabe mostrou superior resulta na depuração da pele em comparação com o adalimumab na análise comparativa.
- Os resultados dos ensaios clínicos também demonstraram a eficácia do guselcumabe em pacientes que tiveram uma resposta inadequada ao tratamento com ustecinumabe.
- Um estudo de fase III avaliando guselcumabe no tratamento de pacientes com psoríase ativa artrite está em andamento e um programa de Fase III avaliando a eficácia do guselcumabe em comparação com o secuquinumabe no tratamento da psoríase em placas moderada a grave está em andamento.
- Embora sejam necessários mais estudos para avaliar a segurança e eficácia a longo prazo, com base nos resultados até à data, o guselcumab parece promissor. terapêutico opção para psoríase em placas moderada a grave.

