Introducción
En julio de 2015, la FDA (Food and Drug Administration) de EE. UU. Aprobó el sonidegib (Odomzo®; Novartis, Nueva Jersey, EE. UU.) Para el tratamiento de pacientes adultos con enfermedad local avanzada basal célula carcinoma (BCC)
La Comisión Europea aprobó el uso de sonidegib para el carcinoma basocelular en agosto de 2015. En junio de 2016, se le otorgó a sonidegib la autorización de comercialización en Suiza para el tratamiento de adultos con carcinoma basocelular avanzado. El medicamento también está aprobado en Australia, pero aún no está disponible en Nueva Zelanda.
Sonidegib es un inhibidor de la vía del erizo. Se une e inhibe Smoothened, una proteína transmembrana implicada en la transducción de señales de Hedgehog, que desempeña un papel fundamental en el mantenimiento de las células madre y la reparación de tejidos.
Sonidegib está indicado para el tratamiento de pacientes adultos con carcinoma basocelular (CBC) localmente avanzado que ha recurrido después de una cirugía o radioterapia, o aquellos que no son candidatos para cirugía o radioterapia.
Carcinoma basocelular avanzado
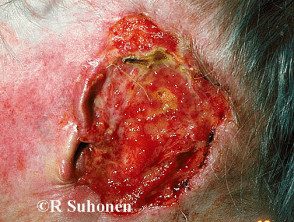
Carcinoma basocelular avanzado
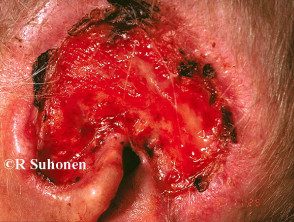
Carcinoma basocelular avanzado
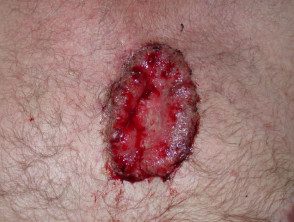
Carcinoma basocelular avanzado
Experiencia en ensayos clínicos con sonidegib
- La aprobación de la FDA se basó en un estudio fundamental de fase II (ensayo BOLT), un centro internacional multicéntrico, doble ciego, aleatorizado, de dos brazos, ensayo no comparativo en pacientes con CCB localmente avanzado que no son susceptibles de terapia local o metastásico carcinoma de células basales.
- Los pacientes fueron aleatorizados (2: 1) para recibir sonidigib 800 mg (n = 151) o 200 mg (n = 79) por vía oral, una vez al día, hasta la progresión de la enfermedad o intolerable toxicidad.
- Aleatorización se estratificó por etapa de la enfermedad (localmente avanzada o metastásica), enfermedad de BCC localmente avanzada histología (agresivo versus no agresivo) y región geográfica.
- Los pacientes con BCC localmente avanzado tratados con sonidegib 200 mg (n = 66) fueron seguidos durante al menos 12 meses a menos que se interrumpieran antes.
- La tasa de respuesta objetiva fue del 58% (intervalo de confianza del 95%: 45-70) consistente en 5% (n = 3) respuestas completas y 53% (n = 35) respuestas parciales.
- Un análisis de sensibilidad preespecificado que utiliza una definición alternativa para la respuesta completa, definida como al menos una respuesta parcial de acuerdo con Resonancia magnética y / o fotografía y sin evidencia de tumor en biopsia de residual lesión, produjo una tasa de respuesta completa del 20%.
- Entre los 38 pacientes con una respuesta objetiva, 31 pacientes (82%) tienen respuestas continuas que van desde al menos 1.9 a 18.6 meses.
- No se ha alcanzado la mediana de la duración de la respuesta.
- No hubo evidencia de una mejor tasa de respuesta objetiva entre pacientes con BCC localmente avanzado aleatorizados para recibir 800 mg de sonidegib diariamente y seguidos durante al menos 12 meses.
- Quimioterapia incluido dacarbazina 1000 mg / m2 cada 3 semanas o la combinación de AUC de carboplatino (área bajo curva) 6 cada 3 semanas más paclitaxel 175 mg / m2 cada 3 semanas
- los primario el punto final fue la tasa de respuesta objetiva (ORR) definida como la proporción de pacientes con respuesta tumoral completa o parcial confirmada, o contracción, medida por un comité de revisión central.
- La evaluación de la respuesta tumoral se basó en una evaluación compuesta que integraba las medidas tumorales obtenidas por evaluaciones radiográficas de las lesiones objetivo (según RECIST 1.1 o mRECIST), fotografía clínica digital y histopatología evaluaciones (a través de punch biopsias)
- Todas las modalidades utilizadas deben haber demostrado ausencia de tumor para lograr una evaluación compuesta de la respuesta completa.
- La duración de la respuesta, determinada por la revisión central cegada, fue una medida de resultado secundaria clave.
Reacciones adversas: experiencia en ensayos clínicos
- Reacción adversa las tasas observadas en los ensayos clínicos de un medicamento pueden no reflejar las tasas observadas en la práctica clínica porque los ensayos clínicos se realizan en condiciones muy variables.
- La frecuencia de efectos adversos comunes fue mayor en pacientes tratados con sonidegib 800 mg en comparación con 200 mg.
- Las tablas 1 y 2 reflejan eventos adversos en> 10% de los pacientes expuestos a sonidegib 200 mg diarios (79 pacientes con BCC localmente avanzado [n=66] o BCC metastásico [13])
- Los pacientes fueron seguidos durante al menos 18 meses.
- La mediana de duración del tratamiento fue de 11.0 meses (rango 1.3 a 33.5 meses).
Musculoesquelético y tejido conectivo trastornos
- Espasmos musculares 54% (3% Grado 3)
- Mialgia (dolor muscular) 19% (0)
- Dolor musculoesquelético 32 (1%)
Piel y subcutáneo trastornos tisulares
- Alopecia 53% (0 Grado 3)
- Prurito 10% (0)
Trastornos del sistema nervioso
- Disgeusia (sabor anormal) 46% (0 Grado 3)
- Dolor de cabeza 15% (1%)
Reacciones en el sitio de administración
- Dolor 14% (1% Grado 3)
Desórdenes gastrointestinales
- Náuseas 39% (1% Grado 3)
- Diarrea 32% (1%)
- Dolor abdominal 18% (0)
- Vómitos 11% (1%)
Metabolismo y nutrición
- Disminución del apetito 23% (1% Grado 3)
Anomalías clave de laboratorio
- Aumentado suero creatina quinasa (músculo enzima) 61% (8% Grado 3–4)
- Hiperglucemia 51% (4%)
- Aumentado alanina aminotransferasa 43% (13%)
- Aumentado aspartato aminotransferasa 19% (4%)
- Aumento de amilasa 16% (1%)
- Anemia 32% (0)
- Linfopenia (reducido linfocitos) 28% (3%)
Seguimiento a largo plazo: experiencia en ensayos clínicos
- Sonidegib mostró actividad antitumoral continua sin nuevos problemas de seguridad en pacientes con carcinoma basocelular avanzado, según los resultados de un seguimiento de 30 meses del ensayo BOLT fundamental presentado en la Reunión Anual de la ASCO 2016.
- La medida de resultado primaria fue la tasa de respuesta objetiva.
- Los puntos finales secundarios incluyeron la duración de la respuesta, la respuesta completa, la supervivencia libre de progresión, la supervivencia general y la seguridad.
- A los 30 meses de seguimiento, los pacientes con CCB localmente avanzado tuvieron una tasa de respuesta objetiva de 56% y 45% a las 2 dosis de estudio de 200 mg y 800 mg de sonidegib, respectivamente.
- Entre los pacientes con CBC metastásico, las tasas de respuesta objetiva a las dosis más bajas y más altas fueron 8% y 17%, respectivamente.
- En el grupo localmente avanzado, la tasa de respuesta completa fue del 5%, la tasa de respuesta parcial fue del 52% y la tasa de enfermedad estable fue del 35%.
- La duración media de la respuesta fue de 26,1 meses, la supervivencia libre de progresión media fue de 22,1 meses y la tasa de supervivencia global a 2 años fue del 93% (IC 95%, 80-98).
- En pacientes con CBC metastásico tratados con la dosis de 200 mg, no hubo respuestas completas, la tasa de respuesta parcial fue del 8%, la tasa de enfermedad estable del 85% y la tasa de progresivo la enfermedad fue 0.
- La mediana de la duración de la respuesta fue de 24 meses, la mediana de supervivencia libre de progresión fue de 13,1 meses (IC del 95%, 5,6-33,1) y la tasa de supervivencia global a 2 años fue del 69% (IC del 95%, 31-89).
- Todos los pacientes que recibieron la dosis de 800 mg y el 97.5% de los pacientes que recibieron la dosis de 200 mg experimentaron al menos 1 acontecimiento adverso.
- Las tasas de eventos adversos de grado 3/4 (43% versus 64%) y eventos adversos graves (20% versus 39%) fueron menores con la dosis de 200 mg versus la dosis de 800 mg.
- Entre los 79 pacientes que recibieron 200 mg de sonidegib, los eventos adversos más comunes de todos los grados fueron espasmos musculares (54%), alopecia (49%), disgeusia (44%), náuseas (39%), diarrea (32% ) y disminución de peso (30%).
- Los eventos adversos de grado 3/4 más comunes fueron aumento de creatinina quinasa (7%), disminución de peso (5%), espasmos musculares (3%).
Direcciones futuras para sonidegib
- Sonidegib ha demostrado eficacia en el tratamiento del carcinoma basocelular no resecable localmente avanzado y metastásico.
- Las toxicidades identificadas son manejables y reversibles tras la interrupción del tratamiento.
- Sin embargo, sonidegib aún no se ha comparado con otros tratamientos inhibidores de la vía hedgehog aprobados para el carcinoma de células basales, como vismodegib.
- Según los resultados presentados en la Reunión Anual de la ASCO 2016, un gran ensayo (ensayo STEVIE; n = 1215) ha confirmado los beneficios de vismodegib para el carcinoma de células basales.
- El perfil aceptable de riesgo-beneficio de sonidegib, junto con la escasez de opciones de tratamiento, hace que sonidegib sea una opción emergente para el tratamiento de adultos con CBC localmente avanzado que ha recurrido después de una cirugía o radioterapia, o en aquellos que no son candidatos para cirugía o radiación. terapia.
- La aprobación continua de sonidegib para el tratamiento del carcinoma basocelular dependerá de la verificación del beneficio clínico en los ensayos confirmatorios.

