Introduction
En febrero de 2017, brodalumab (Siliq ™; Valeant Pharmaceuticals, Nueva Jersey, EE. UU.) Recibió la aprobación de la Administración de Drogas y Alimentos de los EE. UU. (FDA) para tratar la psoriasis en pacientes adultos que no han respondido a otros tratamientos.
Valeant espera comenzar las ventas y la comercialización de brodalumab en los Estados Unidos en la segunda mitad de 2017.
Debido al riesgo observado de ideación y comportamiento suicida, el etiquetado de brodalumab incluye un recuadro de advertencia y el medicamento solo está disponible a través de un programa restringido bajo el Programa de Estrategias de Evaluación y Mitigación de Riesgos (REMS) de la FDA. Los requisitos notables del programa se incluyen a continuación.
- Los prescriptores deben estar certificados con el Programa REMS y aconsejar a los pacientes sobre el riesgo de ideación y comportamiento suicida.
- Los pacientes con síntomas nuevos o que empeoran de depresión o tendencias suicidas deben remitirse a un profesional de salud mental según corresponda.
- Los pacientes deben sign un formulario de acuerdo entre el paciente y el prescriptor y estar al tanto de la necesidad de buscar atención médica si experimentan pensamientos o comportamientos suicidas nuevos o que empeoran, sentimientos de depresión, ansiedad u otros cambios de humor.
- Las farmacias también deben estar certificadas con el programa REMS y solo deben dispensar brodalumab a los pacientes autorizados a recibir el medicamento.
No se ha establecido una asociación causal entre el tratamiento con brodalumab y el mayor riesgo de ideación y comportamiento suicida.
Chronic plaque psoriasis
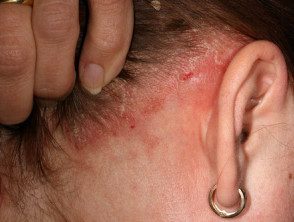
Psoriasis of the scalp
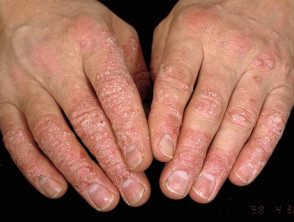
Psoriasis de manos.
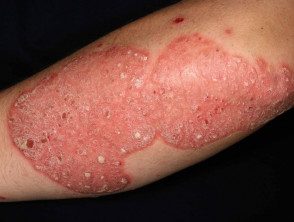
Chronic plaque psoriasis
¿Para qué se utiliza brodalumab?
Brodalumab se usa para el tratamiento de pacientes adultos con moderado a severo license plate psoriasis que son candidatos para systemic terapia o fototerapia y no han respondido, o han dejado de responder a otras terapias sistémicas.
Se recomienda para los candidatos para quienes la terapia sistémica o la fototerapia no han podido proporcionar resultados o un tratamiento adecuado.
¿Cómo funciona brodalumab?
Brodalumab es un monoclonal immunoglobulin G2 (IgG2) antibody eso inhibe inflammatory reacciones y se une selectivamente a la receiver of interleukin 17 (IL-17), un cytokine que inicia inflammation.
El receptor de IL-17 es una proteína expresada en la superficie celular y es un componente de los complejos de receptores utilizados por múltiples familias de IL-17. cytokines, tales como IL-17A, IL-17F, IL-17C, IL-17A / F heterodímero e IL-25. El bloqueo del receptor de IL-17 inhibe las respuestas inducidas por citocinas de IL-17, incluida la liberación de proinflammatory citoquinas y chemokines asociado con el Pathogenesis psoriasis
¿Cómo se administra brodalumab?
Brodalumab se administra por vía subcutánea. Cada jeringa precargada (1,5 ml) contiene 210 mg de brodalumab y es para un solo uso.
- La dosis recomendada para brodalumab es de 210 mg administrados por subcutaneous inyección en las semanas 0, 1 y 2, seguido de 210 mg cada 2 semanas.
- Si no se logra una respuesta adecuada después de 12-16 semanas de tratamiento, se debe suspender el tratamiento con brodalumab.
- Brodalumab no debe inyectarse en áreas donde la piel está sensible, magullada, roja, dura, gruesa, scaly, o afectado por la psoriasis.
- Brodalumab es contraindicated en pacientes con enfermedad de Crohn porque el medicamento puede empeorar la enfermedad.
- Pacientes con antecedentes de latent la tuberculosis debe tratarse antes de la administración de brodalumab, que puede reactivar la tuberculosis latente infection.
El uso de brodalumab en poblaciones específicas
Pregnant women
No hay datos disponibles sobre el uso de brodalumab en mujeres embarazadas para informar a los médicos sobre el riesgo asociado con medicamentos de defectos congénitos y abortos espontáneos.
No se han observado efectos adversos en el desarrollo en monas preñadas después de la administración subcutánea de brodalumab hasta 26 veces la dosis máxima recomendada para humanos. (Consulte Seguridad de los medicamentos tomados durante el embarazo para obtener más información).
Breastfeeding women
No hay información sobre la presencia de brodalumab en la leche humana o sus efectos en el lactante. El potencial riesgo-beneficio se debe considerar al recetar brodalumab a una madre lactante. (Ver Lactancia y la piel).
Children
La seguridad y eficacia de brodalumab no se han evaluado en pediatric patients
Old people
Los estudios clínicos con brodalumab no incluyeron un número suficiente de sujetos de 65 años o más para determinar si las personas mayores responderán de manera diferente a las personas más jóvenes.
Individuals with hepatic or renal disability
No se han realizado ensayos para evaluar el uso de brodalumab en pacientes con insuficiencia hepática o renal.
¿Cuáles son los riesgos con brodalumab?
Adverse events
The most common Adverse reactions (≥ 1% de los pacientes) informados con brodalumab incluyen:
- Arthralgia (joint pain)
- Headache
- Fatigue
- Diarrhea
- Oropharyngeal dolor (dolor de garganta)
- Nausea
- Myalgia (dolor muscular)
- Injection site reactions
- Influenza
- Neutropenia (low white blood cell count)
- Infecciones fúngicas (como tiña).
Se han informado las siguientes reacciones adversas graves en ensayos clínicos en pacientes tratados con brodalumab:
- Ideación y comportamiento suicida
- Infecciones graves como el criptococo meningitis
-
Reactivación tuberculosa latente
- Exacerbation de la enfermedad de Crohn.
Drug interactions
No hay datos disponibles sobre la capacidad de las vacunas vivas o inactivas para provocar una respuesta inmune en pacientes que reciben tratamiento con brodalumab. Las vacunas vivas no deben usarse durante el tratamiento con brodalumab.
El efecto de las drogas metabolizadas a través del citocromo hepático P450 enzymes (como warfarina y ciclosporina) pueden alterarse durante concurrent administración con brodalumab. Se debe considerar la modificación de las dosis de estos medicamentos.
Contraindications
Brodalumab está contraindicado en personas que:
- Tiene antecedentes de problemas mentales, incluidos pensamientos suicidas, depresión, ansiedad o problemas de humor.
- Tiene infecciones recurrentes.
- Tiene tuberculosis o ha estado en contacto cercano con alguien con tuberculosis.
- Ha recibido recientemente, o tiene previsto recibir, una vacuna
- plan to get pregnant
- Actualmente está amamantando o planea amamantar.
¿Cuál es el pronóstico para el tratamiento con brodalumab?
Brodalumab ha mostrado un perfil de seguridad aceptable y bueno effectiveness en el tratamiento de la psoriasis en placas de moderada a grave. Proporciona una nueva terapia importante en el tratamiento de la psoriasis donde sigue habiendo una importante necesidad insatisfecha de nuevos agentes con nuevos mecanismos de acción, un rápido inicio de efecto y un aclaramiento total y mejorado de la piel, al tiempo que ayuda a una mayor adherencia del paciente y minimiza el fármaco específico preocupaciones de seguridad.
Sin embargo, la evidencia actual de brodalumab es insuficiente para confirmar el mantenimiento de estos resultados a largo plazo.
